 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!  Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!
 Here come GMP Grade Cytokines!Free Sample is available!
Here come GMP Grade Cytokines!Free Sample is available!  Here come GMP Grade Cytokines!Free Sample is available!
Here come GMP Grade Cytokines!Free Sample is available!
> 감염병 연구를 위한 핵심 시약

RSV |
VZV |

RABV |

Influenza |
MPXV |
HIV |

HSV |
EBV |
NiV |
HeV |
EBOV |
ZIKV |
DENV |
SFTSV |
Coronavirus |
Rotavirus |
Coxsackievirus |
HCMV |
MuV |
hMPV |

JEV |
>>> SARS-CoV-2 관련 제품:코로나19 백신 연구개발 핵심시약, 진단키트 개발을 위한 항원 및 항체, ELISA를 기반으로 하는 백신 R&D를 위한 고처리량 솔루션
>>> 인기 제품: 혈구응집소 (HA), 뉴라미니다아제 (NA)
>>> 인기 제품:당단백질, 항-RABV 당단백질 항체
>>> 인기 제품: 당단백질
>>> 인기 제품: gp41, gp120, Capsid protein p24, HLA-A*0201 | B2M & HIV Gag (SLYNTVATL)
>>> 인기 제품: 당단백질 E
>>> 인기 제품: NS1
>>> 인기 제품:Gn 단백질
>>> Hot Products: gH&gL , Glycoprotein C (HSV-2), Glycoprotein D (HSV-1), Glycoprotein D (HSV-2), Glycoprotein E (HSV-2), post-gB
>>> Hot Products: gp350, Glycoprotein H & Glycoprotein L (EBV), Glycoprotein B (EBV)
>>> Hot Products: Pre-Fusion glycoprotein, Glycoprotein (NiV, HeV), ephrinB2
>>> Hot Products: Envelope protein, NS1
>>> Hot Products: VP4
>>> Hot Products: VP0
>>> Hot Products: Glycoprotein B / gB, gH&gL&gO:
>>> Hot Products: HN protein, Fusion glycoprotein F0, Mumps virus HN
>>> Hot Products: Post-Fusion glycoprotein F0
>>> Hot Products: Envelope protein E (JEV)
![]() HEK293 발현: 단백질 구조가 자연 구조에 더 가깝습니다.
HEK293 발현: 단백질 구조가 자연 구조에 더 가깝습니다.
![]() SDS-PAGE 및 MALS에 의해 검증된 고순도;
SDS-PAGE 및 MALS에 의해 검증된 고순도;
![]() 항원-항체 또는 항원-수용체 결합 실험에 의해 검증된 높은 생체 활성;
항원-항체 또는 항원-수용체 결합 실험에 의해 검증된 높은 생체 활성;
![]() 더 높은 항체 역가를 유도할 수 있는 높은 면역원성;
더 높은 항체 역가를 유도할 수 있는 높은 면역원성;
![]() 약물 스크리닝 및 백신 개발에 사용할 수 있습니다.
약물 스크리닝 및 백신 개발에 사용할 수 있습니다.
RSV
influenza
VZV
MPXV
HIV
RABV
HSV
NiV
HeV
ZIKV
DENV
SFTSV
EBV
EBOV
Rotavirus
Coxsackievirus
LCMV
Vaccinia Virus
HCMV
hMPV
JEV
HPV
MuV
RV
HTNV
TBEV
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
| product type | molecule | Cat. No. | Product Description |
|---|
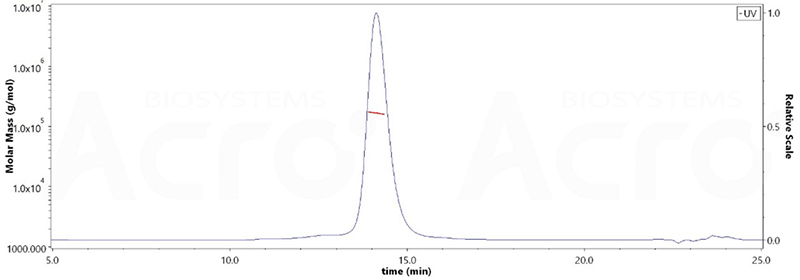
The purity of HRSV (A) Fusion glycoprotein F0, His Tag (Cat. No. RSF-V52H6) is more than 95% verified by SDS-PAGE and 90% and verified by SEC-MALS. The molecular weight of this protein is around 148-182kDa.
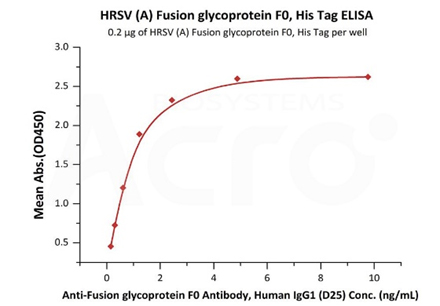
Immobilized HRSV (A) Fusion glycoprotein F0, His Tag (Cat. No. RSF-V52H7) at 2 μg/mL (100 μL/well) can bind Anti-Fusion glycoprotein F0 Antibody, Human IgG1 (D25) with a linear range of 0.2-1 ng/mL (QC tested).
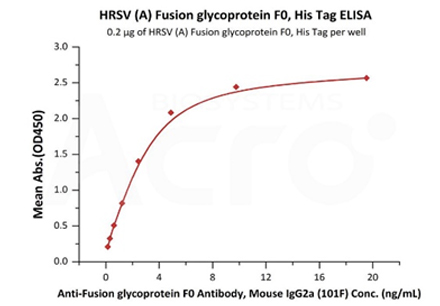
Immobilized HRSV (A) Fusion glycoprotein F0, His Tag (Cat. No. RSF-V52H7) at 2 μg/mL (100 μL/well) can bind Anti-Fusion glycoprotein F0 Antibody, Mouse IgG2a (101F) with a linear range of 0.2-5 ng/mL (Routinely tested).
Loaded Monoclonal Anti-SARS-CoV-2 Spike RBD Antibody, Mouse IgG1 (Cat. No. SPD-M305) on AMC Biosensor, can bind SARS-CoV-2 Spike RBD, His Tag (B.1.1.529/Omicron) (Cat. No. SPD-C522e) with an affinity constant of 9.07 nM as determined in BLI assay (ForteBio Octet Red96e).
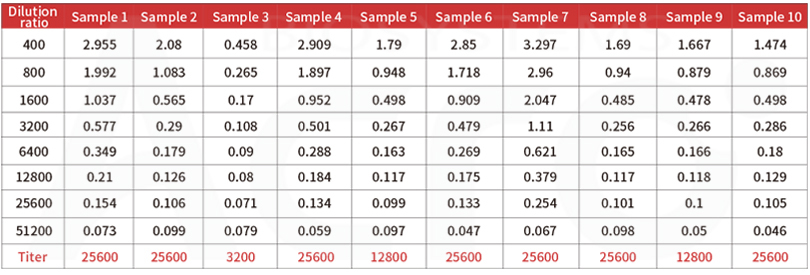
Post-vaccination serum samples are tested with Anti-SARS-CoV-2 Antibody IgG Titer Serologic Assay Kit (Spike RBD) (Cat. No.RAS-T024), which accurately and precisely measure antibody titer in serum (Accuracy≤±15%; Intra-assay precision<10%; Inter-assay precision <15%).
This web search service is supported by Google Inc.
