























 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!  Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free!
 Here come GMP Grade Cytokines!Free Sample is available!
Here come GMP Grade Cytokines!Free Sample is available!  Here come GMP Grade Cytokines!Free Sample is available!
Here come GMP Grade Cytokines!Free Sample is available!
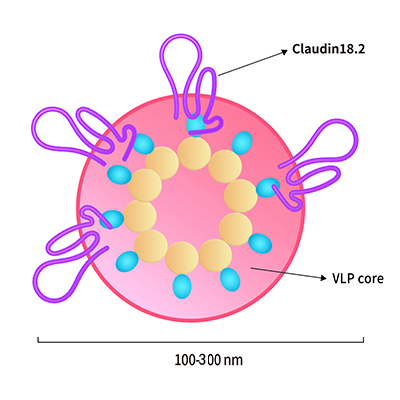
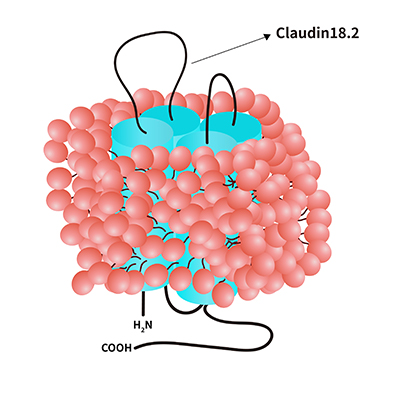
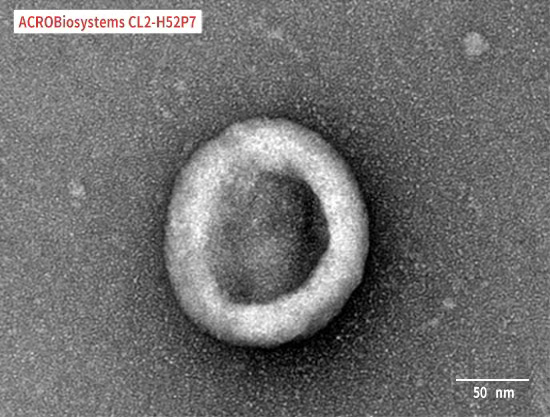
> 4-패스 막관통 단백질 Claudin 18.2(HEK293 발현)
다음 ELISA/SPR/BLI/FACS 데이터는 참고용으로 내부 실험 운영 방법에 대해 무료로 제공될 수 있습니다. 프로토콜을 클릭하고 신청하면 됩니다.
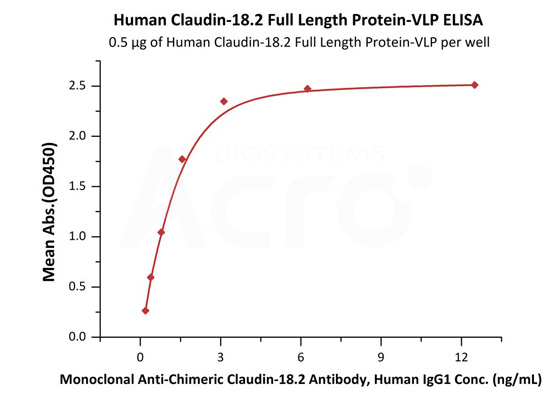
Immobilized Human Claudin-18.2 Full Length Protein-VLP (Cat. No. CL2-H52P7) at 5 μg/mL (100 μL/well) can bind Monoclonal Anti-Chimeric Claudin-18.2 Antibody, Human IgG1 with a linear range of 0.2-3 ng/mL (QC tested).
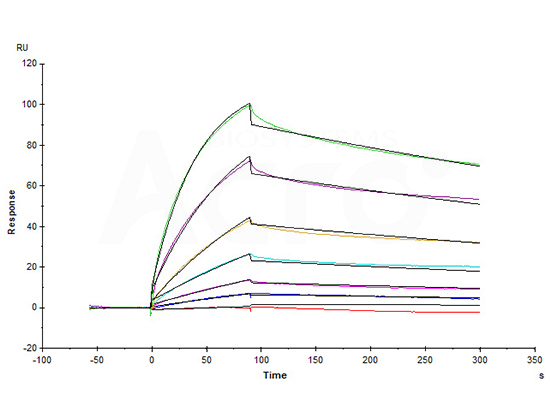
Human Claudin-18.2 Full Length Protein-VLP (Cat. No. CL2-H52P7) captured on CM5 Chip via Anti-Claudin-18.2 antibody can bind Anti-Claudin-18.2 antibody with an affinity constant of 0.374 nM as determined in a SPR assay (Biacore T200) (Routinely tested).
FACS로 검증됩니다. Claudin18.2-CAR-293 세포에 Human Claudin18.2-VLP 단백질(Cat. No. CL2-HF218)과 음성 대조군 단백질(Cat. No. VLP-NF2P4)을 각각 형질감염시켰다. Claudin18.2-VLP 단백질(Cat. No. CL2-HF218)은 Claudin18.2-CAR-293 세포에 특이적으로 결합할 수 있음을 보여주었습니다.
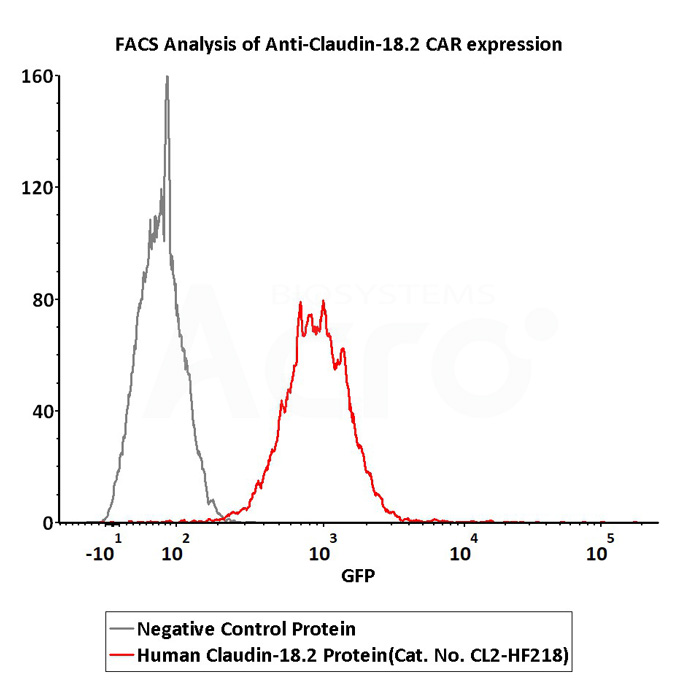
2e5 of Anti-Claudin-18.2 CAR-293 cells were stained with 100 μL of 3 μg/mL of Fluorescent Human Claudin-18.2 Full Length Protein-VLP (Cat. No.CL2-HF218) and negative control protein respectively, FITC signals was used to evaluate the binding activity (Routinely tested).
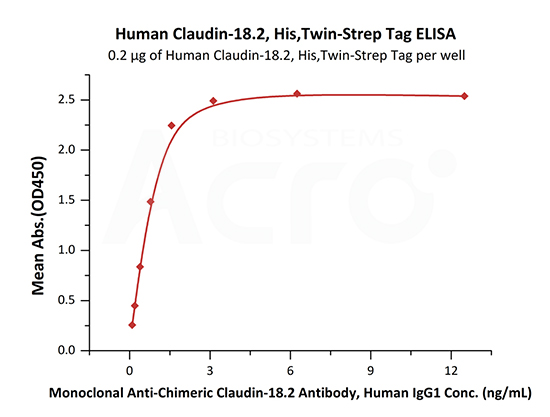
Immobilized Human Claudin-18.2, His,Twin-Strep Tag (Cat. No. CL2-H5587) at 2 μg/mL (100 μL/well) can bind Monoclonal Anti-Chimeric Claudin-18.2 Antibody, Human IgG1 with a linear range of 0.1-2 ng/mL (QC tested).
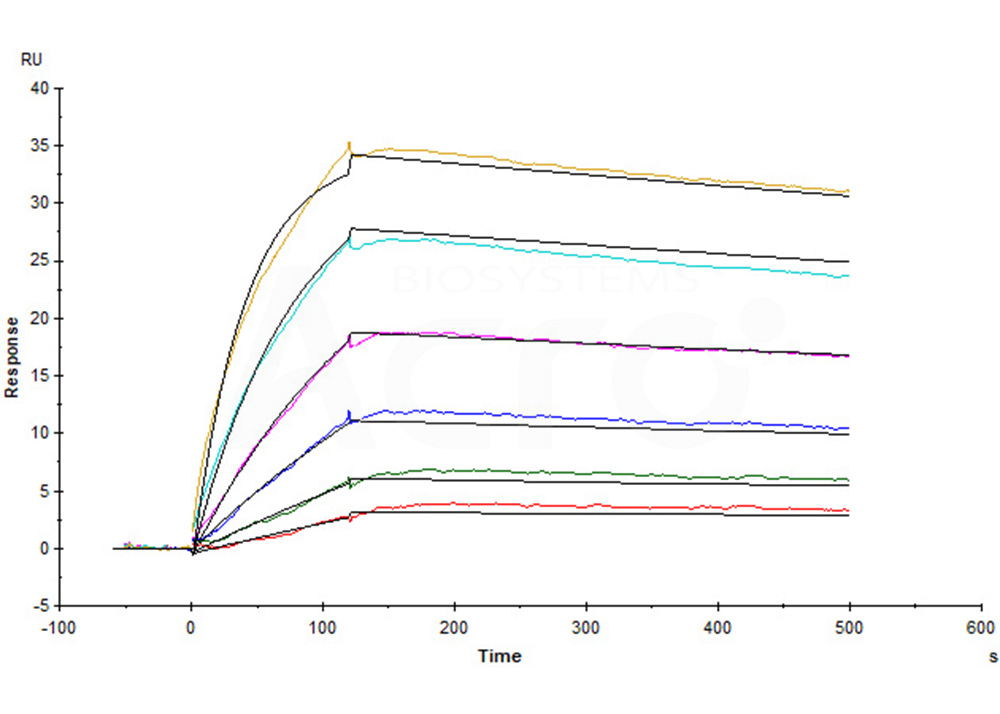
Anti-Claudin-18.2 mAb captured on CM5 chip via anti-Human IgG (Fc) antibody can bind Human Claudin-18.2, His,Twin-Strep Tag (Cat. No. CL2-H5587) with an affinity constant of 6.72 nM as determined in a SPR assay (in presence of DDM and CHS) (Biacore T200) (Routinely tested).
| Name | Research Code | Research Phase | Company | Indications | Clinical Trials |
|---|
This web search service is supported by Google Inc.








 전장(full-length) Claudin18.2-VLP
전장(full-length) Claudin18.2-VLP